Ikatan Kovalen
Ikatan Kovalen adalah ikatan yang terjadi jika adanya penggunaan elektron secara bersamaan oleh atom yang berikatan, serta ikatan ini terjadi antara unsur logam dan non logam. Bahasa mudahnya adalah pemakaian elektron secara bersama sama. sebagai contoh adanya ikatan yang membentuk senyawa air yaitu (H2O), masing masing atom menyumbangkan 2 buah elektron.
Ikatan kovalen akan menjadi stabil jika seluruh atom berjumlah 8 elektron (Teori Oktet), namun ada juga atom yang menyalahi teori oktet tetapi itu tidak menjadi masalah.
Pembentuk ikatan Kovalen
Seperti yang dijelaskan di atas, ikatan kovalen terjadi akibat pemakaian pasangan elektron secara bersama-sama oleh dua atom (non logam). Misalkan saja ikatan antara H (hidrogen) yang atom luarnya 1 dan Cl (klorida) yang atom luarnya 7. Kedua unsur tersebut merupakan unsur non logam. Untuk mencapai ikatan yang stabil baik H dan Cl memerlukan 1 elektron. Jadi 1 atom H akan berpasangan dengan 1 atom Cl.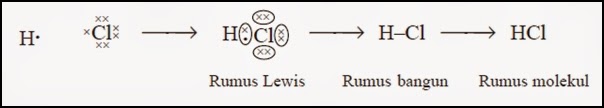 |
| Ikatan Kovalen Menurut Struktur Lewis |
Jenis Jenis Ikatan Kovalen
Ikatan kovalen koordinasi adalah ikatan kovalen di mana pasangan elektron yang dipakai bersama hanya disumbangkan oleh satu atom, sedangkan atom yang satu lagi tidak menyumbangkan elektron. Ikatan kovalen koordinasi hanya dapat terjadi jika salah satu atom mempunyai pasangan elektron bebas (PEB).
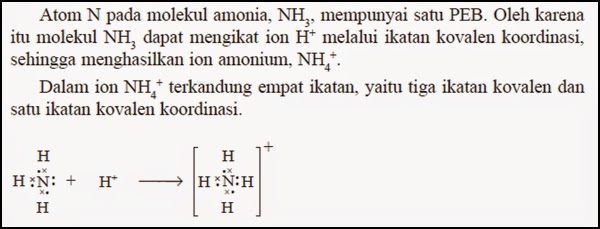 |
| Contoh Ikatan Kovalen Koordinasi |
Kepolaran Ikatan Kovalen
Perbedaan keelektronegatifan dua atom menimbulkan kepolaran senyawa. Adanya perbedaan keelektronegatifan tersebut menyebabkan pasangan elektron ikatan lebih tertarik ke salah satu unsur sehingga membentuk dipol. Adanya dipol inilah yang menyebabkan senyawa menjadi polar.Pada senyawa HCl, pasangan elektron milik bersama akan lebih dekat pada Cl karena daya tarik terhadap elektronnya lebih besar dibandingkan H. Hal itu menyebabkan terjadinya polarisasi pada ikatan H – Cl. Atom Cl lebih negatif daripada atom H, hal tersebut menyebabkan terjadinya ikatan kovalen polar.
![Ikatan Kovalen [Polar dan Non Polar]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEjMVcbo2jbDApRhcT14GCvnp2JJnOVVEUZ3hBaMkLOJkPT_8JyXRtMwhUxET72prnorVBdg_9FC4bHFAvPtAkbT_djxZnwx6YPTTpM1mHO-VcYUu5-can4-zziSpK5dlcQUl8dsSXnwh18/s1600/Ikatan+Kovalen+3.jpg) |
| Kepolaran Ikatan Kovalen |






.jpg)


No comments:
Write comments